Опубликованная в журнале «Science» (1998, v. 279, p. 349-352) статья американских ученых благодаря средствам массовой информации привлекла внимание не только ученых, а в первую очередь не ученых, в связи с проблемами старения и давно ожидаемого бессмертия. В прекрасной работе удалось увеличить в 1,5 раза число делений нормальных соматических клеток человека в культуре благодаря введению и экспрессии гена теломеразы. Активность этого фермента у высших эукариот обнаружена лишь в трех типах клеток: генеративных, раковых и линиях иммортализованных клеточных культур. При дифференцировке клеток теломераза репрессируется. Экспрессию теломеразы считают фактором иммортализации клеток.
Что же представляет из себя этот фермент? В 1985 г. он был обнаружен Грейдером и Блэкберном у равноресничной инфузории Tetrahymena thermophila, а впоследствии — в дрожжах, растениях и животных, в том числе в яичниках человека и иммортализованных линиях раковых клеток HeLa. Это ДНК-нуклеоти-дилэкзотрансфераза или теломерная терминальная трансфераза — фермент, достраивающий 3’-концы линейных молекул ДНК хромосом короткими повторяющимися последовательностями (у позвоночных TTAGGG). Помимо белковой части, теломераза содержит РНК, выполняющую роль матрицы для наращивания ДНК повторами. Длина теломеразной РНК колеблется от 150 нуклеотидов у простейших до 1400 нуклеотидов у дрожжей. Сам факт наличия в РНК последовательности, по которой идет матричный синтез куска ДНК, позволяет отнести теломеразу к своеобразной обратной транскриптазе.
Открытие теломеразы было «ожиданным» и предсказанным. Необходимость в подобном ферменте диктовалась «проблемой концевой репликации». Суть ее в том, что все известные ДНК-полимеразы способны вести синтез лишь в одном направлении 5’ ® 3’ и при этом нуждаются в одноцепочечной ДНК-матрице и 3’-ОН конце затравки. Функцию затравки (праймера) выполняет РНК, образуемая ферментом репликативного комплекса — праймазой. Удаление РНК-праймеров после завершения синтеза ДНК в виде фрагментов Оказаки и заделывание образующихся между фрагментами брешей нуклеотидами ДНК приводит к тому, что дочерние цепи ДНК оказываются короче материнских на размер первого РНК-праймера (10- 20 нуклеотидов). Образуются 3’-оверхенги, т.е. выступающие 3’-концы материнских цепей. Они-то и узнаются теломеразой, которая последовательно наращивает материнские цепи (у человека на сотни повторов), используя 3’-ОН концы их в качестве затравок, а РНК, входящую в состав фермента, в качестве матрицы. Образующиеся длинные одноцепочечные концы в свою очередь служат матрицами для синтеза дочерних цепей традиционным репликативным механизмом.
Хромосомы соматических клеток человека кэпированы многократно повторенными гексамерами TTAGGG, общая длина которых может достигать 10 тысяч пар нуклеотидов. В комплексе со специфическими белками такие тандемные повторы образуют теломеры, защищающие концы ДНК от действия экзонуклеаз, предотвращающие неправильную рекомбинацию и позволяющие концам хромосом прикрепляться к ядерной оболочке. Известно, что в ходе пассирования некоторых клонов нормальных клеток (например, фибробластов человека) происходит укорочение теломер в среднем на 50 пар нуклеотидов за каждый цикл деления. Подобное укорочение хромосом происходит in vivo в лейкоцитах периферической крови, в клетках эпидермия кожи, в эпителии толстого кишечника человека.
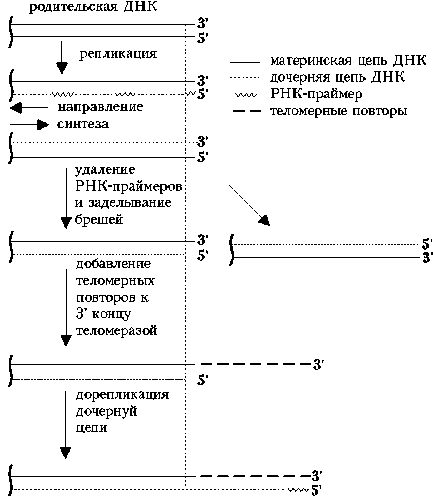
Еще в 1971 г. А.М.Оловников в своей «теории маргинотомии» предположил, что постепенное укорочение хромосом может лежать в основе ограниченного потенциала удвоения, наблюдаемого у нормальных соматических клеток, растущих in vitro, так называемого «лимита Хейфлика». Длина теломер достоверно коррелирует с пролиферативным потенциалом (например, в фибробластах человека). Укорочение теломер может играть роль митотических часов, отсчитывающих число делений клетки. По достижении критической длины теломерной ДНК запускаются процессы остановки клеточного цикла.
А.Оловников тоже выдвинул гипотезу о существовании особого биологического механизма, решающего «проблему концевой репликации», предположив, что он действует в клетках организмов, размножающихся вегетативным путем, а также в половых и раковых клетках, но не работает в большинстве наших соматических клеток. Наращивание теломеразой концов линейных молекул и есть этот механизм. Поскольку теломерные последовательности не являются кодирующими, они выступают в роли буферной зоны как защита от «проблемы концевой репликации». Укорочение ДНК в ходе каждого раунда репликации лишь сокращает нетранскрибируемый текст теломеры, но не приводит к утрате смысловых последовательностей — генов и регуляторов их экспрессии.
Укорочение теломер можно рассматривать как молекулярный индикатор количества делений, но не старения клетки. Так, культуры нормальных фибробластов человека, взятых от доноров в возрасте от 0 до 93 лет, выявили корреляцию между начальной длиной теломер и пролиферативной способностью клетки во всем диапазоне возрастов. А размер теломерной ДНК сперматозоидов не укорачивался в соответствии с возрастом мужчины, что говорит об экспрессии теломеразы в линии половых клеток. Выключение гена теломеразы, происходящее в подавляющем большинстве дифференцированных соматических клеток, является, по-видимому, одним из необходимых компонентов на пути достижения биологической целесообразности.
Старение особи — это нормальная биологическая функция, способствующая прогрессивной эволюции вида, размножающегося половым путем. Давление естественного отбора ослабевает после достижения животным репродуктивного успеха, поскольку существование особи после этого имеет меньшее значение для вида. «Смерть от старости очищает популяцию от предков и дает простор потомкам — носителям новых полезных признаков» (цит. по: Скулачев В.П., Биохимия, 1997, т. 62, в. 11, с. 1394-1399). Как любая важная биологическая функция, старение обусловлено параллельным действием нескольких молекулярных механизмов. Выключение теломеразы — лишь один из них.
Рассматривать гены, кодирующие белковые субъединицы и РНК, образующие теломеразу, как «гены бессмертия» по меньшей мере неверно. Не думаю, что бессмертие, достигнутое раковыми клетками, в том числе путем экспрессии теломеразы, — это то, к чему нужно стремиться. Лекарства от смерти нет. А тот факт, что введение в клетки HeLa антисмысловой конструкции против РНК-компонента теломеразы приводит к укорочению теломер с последующей гибелью клеток, вселяет надежду на появление новых средств борьбы с раком.
Понимание механизма работы теломеразы и главное, регуляции экспрессии ее в клетке приблизит нас к пониманию процессов старения и злокачествен-ной трансформации.
Г.М. Дымшиц, проф., зав. лаб. структуры генома
ИЦиГ СО РАН, Новосибирск

