Напомним кратко, в чем заключалась «зеленая революция», за которую Норман Борлоуг получил Нобелевскую премию мира в 1970 году. К середине XX века сельское хозяйство получило огромное количество минеральных удобрений, но ранее созданные сорта не могли трансформировать их эффективно в урожай зерна. Высокие агрофоны приводили к избыточному росту, набору большой зеленой массы и полеганию, что существенно снижало намолоты. При этом индекс урожая был значительно ниже 50% (отношение веса зерна к общему весу наземной массы, т.е. основное сухое вещество было в соломе и листьях). Борлоуг в целях борьбы с полеганием предложил использовать признак короткостебельности, достаточно просто контролирующийся генетически и легко передающийся через гибридизацию любым перспективным линиям. Полученные им полукарликовые сорта также формировали большую наземную массу, но уже за счет высокой кустистости, не полегали и были весьма продуктивны с индексом урожая ~50%. Кроме того, они имели иную динамику восстановления азота и переноса в зерно его биологических производных.
Сорта, создававшиеся ранее, вначале накапливают соединения азота в зеленой массе, а затем после цветения переносят их в зерновки. Короткостебельные сорта отличаются тем, что восстанавливают и ретранслоцируют азот одновременно до конца налива семян. Таким образом, усвоение азота из почвы у них продолжается много дольше и приводит к большей продуктивности как отдельных растений, так и посева в целом. Благодаря «зеленой революции», Мексика увеличила производство пшеницы в 3 раза за 15 лет (на аналогичный прирост Европе потребовалось 150 лет!!!) и из крупнейшего импортера превратилась в экспортера зерна.
Таким образом, для успешной «революции» необходимо, чтобы базовый признак, на основе которого строится селекционная технология, имел простой генетический контроль и 100% пенетрантность (т.е. полное проявление у всех потомков), иначе невозможно создать и поддерживать необходимую для селекционной практики устойчивую генетическую систему.
В конце прошлого века наиболее сенсационным научным событием, несомненно, было клонирование овцы в Эдинбурге. Это и понятно, так как сразу же явно и неявно этот результат примерялся к человеку, а его возможные последствия будоражат общество до настоящего времени. Возможно поэтому сообщения в СМИ и научных изданиях на Западе об «апомиктической революции» и ее перспективах в России прошли незаметно. Приведем заголовки лишь некоторых из них: «Апомиксис: социальная революция сельского хозяйства» (Biotechnology and Development Monitor, № 19, June, 1994); «Апомиксис: бесполая революция» (Science, V. 274, 1996); «Революция в производстве гибридной кукурузы» (Agricultural Research, December, 1998); «Никакого секса, пожалуйста, мы — растения» (Economist, September, 6, 1997); «Огромное будущее апомиксиса» (Trends in Plant Science, V. 3, № 11, 1998).
Из приведенного списка видно, что в обсуждении проблемы прикладного использования генетически регулируемого апомиксиса термин «революция» используется как научными, так и популярными изданиями. Иными словами, все признают насколько велики будут преобразования агротехнологий в случае освоения данного способа репродукции растений.
Поскольку апомиксис — не что иное как специфический способ размножения, позволяющий получать абсолютные генетические копии матери (природой созданная технология клонирования), начнем наше знакомство со сравнительного анализа полового и апомиктичного типов размножения, чтобы понять, в чем их принципиальная разница и значение для селекционных технологий.
Наиболее часто встречающийся и знакомый всем способ размножения сельскохозяйственных растений — половой — связан с циклическим чередованием спорофитной и гаметофитной фаз (рис. 1). Спорофит — это обычная наблюдаемая нами форма растений, несущая двойной набор хромосом (2n). Гаметофитная фаза у цветковых растений весьма коротка и характеризуется гаплоидным набором хромосом (n). Напомним, что хромосомы являются структурными элементами ядер клеток, состоящими из ДНК, хранящими практически всю генетическую информацию. Их число и форма строго специфичны для каждого вида растений. В обычном состоянии хромосомы не видны в световой микроскоп, но при подготовке к делению клеток ДНК конденсируется с помощью специальных белков, и их можно четко наблюдать на стадии метафазы, а некоторые даже идентифицировать по морфологии. Таким образом и удалось установить, что спорофит несет двойной набор хромосом (2n), а гаметофит — одинарный (n). Это достигается при переходе от спорофитной фазы к гаметофитной путем специального типа клеточного деления — мейоза, приводящего к редукции числа хромосом при формировании как женских, так и мужских половых продуктов. В результате образуются гаплоидные микроспоры (мужские) и мегаспоры (женские), которые путем ограниченного числа митотических делений формируют микрогаметофит (трехъядерная пыльца — результат двух последовательных делений, при этом второе деление осуществляется одной из клеток) и мегагаметофит (8-ядерные зародышевые мешки, заключенные в материнскую семяпочку, результат трех делений). После завершения делений идет специализация ядер — к настоящему моменту не очень исследованный процесс, но установлено, что при этом происходит химическое и конформационное маркирование их ДНК, и в дальнейшем они будут способны выполнять только предписанные функции. Так, один спермий предопределен оплодотворить только яйцеклетку, а другой — центральную клетку. Отсюда ясно, что в мегагаметофите каждое из 8 ядер тоже выполняет только свою функцию.
Итак, после опыления микрогаметофит доставляет два гаплоидных ядра спермиев в мегагаметофит через проникающую в семяпочку пыльцевую трубку. Один оплодотворяет центральную клетку, которая, как правило, двухъядерная (n + n), с формированием триплоидного эндосперма (3n) — терминальной ткани с множественными гормональными и питательными функциями, критическими для развивающегося зародыша; другой — гаплоидную яйцеклетку (n) с формированием зиготического диплоидного зародыша (2n). Замечательное следствие этих событий в том, что набор хромосом во вновь образованном спорофите снова диплоидный, но генотип каждого потомка (совокупность генов) качественно отличается от родительских.
В чем смысл достаточно длинных путей создания и объединения половых продуктов? Казалось бы, проще размножаться почкованием, чем тратить энергию, пластические вещества на формирование генеративных органов, «рисковать» оказаться неопыленными, т.е. не оставить потомства, и поэтому выбыть из борьбы за существование. Это связано с необходимостью постоянно адаптироваться к меняющимся условиям среды, т.е. иметь запас вариабельности, что и достигается через комбинативную изменчивость, сопровождающую половое размножение.
Так, например, у ячменя имеется 7 пар хромосом, поэтому при формировании половых продуктов возможны 27 вариантов их комбинаций. В свою очередь, при оплодотворении возможное число вариантов потомков будет равно числу сочетаний из 128 (27 ) по 2, что обеспечивает огромный резерв изменчивости.
Кроме того, размножение через семенную фазу, в отличие от вегетативного, служит мощным барьером против клеточных инфекций. Вспомните здесь, сколько проблем доставляет картофель, который поражают более 500 видов внутриклеточных паразитов.
Если в дикой природе комбинативная изменчивость является необходимым компонентом устойчивости и приспособляемости вида, то у культурных сортов она часто весьма нежелательна, так как разрушает ценные комбинации генов, контролирующих хозяйственно полезные признаки, по крупицам собираемые поколениями селекционеров. Поэтому существует настоятельная необходимость в отдельных случаях уйти от половой репродукции и одна из возможностей сделать это — бесполосеменное размножение (апомиксис). Он достигается, когда половой жизненный цикл укорочен за счет элиминации гаплофазы, а эмбриогенез осуществляется в результате деления клеток, не прошедших ни мейотической редукции числа хромосом, ни оплодотворения (рис. 1). При этом осуществляется исключительная передача полного материнского генотипа следующему поколению, т.е. его клонирование.
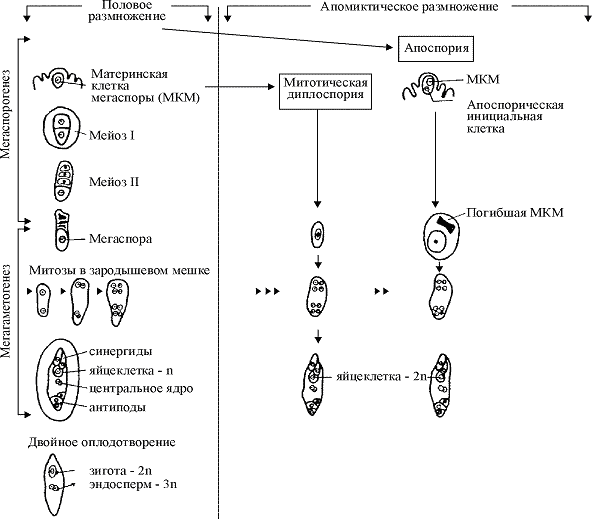
Рис. 1. Сравнительная схема формирования женских половых продуктов у половых и апомиктичных растений.
Необходимо подчеркнуть, что у абсолютного большинства апомиктов оплодотворение эндосперма необходимо, иначе зерновки не развиваются. Это объясняется эффектом импринтинга, требующим для нормального развития этого органа присутствия в нем отцовского генетического материала. При этом у растений, размножающихся половым путем, соотношение материнского и отцовского геномов должно быть строго 2 : 1 соответственно, а у апомиктов возможны разного типа отклонения от данного правила, на которых мы остановимся позже в связи с актуальностью этого эффекта для формирования урожая.
В основном в природе встречаются два типа апомиксиса — диплоспория и апоспория (рис. 1). При диплоспории зародышевый мешок развивается из материнской клетки мегаспоры без редукционного деления, и таким образом неоплодотворенная яйцеклетка, которая далее дает начало следующему поколению, воспроизводит генетическую копию материнского растения. При апоспории эмбриональный мешок формируется из соматической клетки и также является абсолютным генетическим клоном.
Отсюда можно заключить, что бесполосеменное размножение позволяет поддерживать генетически стабильный клон через семенную фазу неограниченно долго. Если добиться генетически контролируемого превращения половых растений в апомиктические, то мы революционизируем селекционные технологии. Так, например, гетерозисные гибриды становятся все более важными у различных пищевых растений по всему миру. Однако массовое производство гибридных семян является дорогой технологией и рентабельно только тогда, когда от одного акта опыления получают не менее 500-1000 семян. По этим причинам гетерозис успешно реализован на практике только у культур с высоким коэффициентом размножения (кукуруза, томаты, огурцы и т.д.). Основные хлебные злаки и рис, несмотря на многочисленные попытки, остались за чертой гибридной селекции, а решение этой проблемы позволило бы увеличить их производство на 15-30% на уже освоенных площадях.
Поэтому закрепление комбинаций генов, контролирующих важные агрономические признаки, — весьма насущная проблема.
Здесь возможны два подхода: создание многолетних сортов и использование генетически регулируемого апомиксиса. В первом случае мы исключаем лишь ежегодную необходимость получать гибриды и проводить сев, а во втором получаем комбинации, которые можно использовать теоретически бесконечно долго. Бесполосеменное размножение, несомненно, предпочтительнее, поскольку позволит поддерживать севообороты и исключить инфекции, распространяемые при вегетативном размножении и не проходящие через зародышевые мешки.
Для этого необходимо создать гибриды, размножающиеся апомиктически, генетическая комбинация которых постоянно воспроизводится у потомков по аналогии с «вечным двигателем» — perpetuum hybrid.
Многие дикие растения от природы апомиктичны, однако среди культурных видов имеются лишь единичные кормовые травы. В связи с этим у читателя может возникнуть вопрос: если апомикты имеют столько замечательных качеств, почему они оказались вне практического использования? Ответ прост: именно отсутствие необходимой для совершенствования растений вариабельности не позволяло отбирать среди них необходимые для селекции варианты. Поскольку еще в самом начале доместикации растений человек подбирал материал по способности выщеплять варианты, что позволяло пересортировывать признаки, используя половое размножение, и таким образом улучшать агрономические качества при массовом отборе. Апомиксис как раз исключает эту возможность. В свое время отсутствие расщепления в опытах на апомиктичной ястребинке заставило Менделя усомниться во всеобщем характере принципов гибридологического поведения признаков, открытых им на горохе. По этой же причине только в самое последнее время удалось лучшить
некоторые кормовые апомиктичные растения.
Создание апомиктичных сортов должно существенно изменить систему организации сельского хозяйства. Они будут стимулировать многообразные стратегии для оптимизации агроэкосистем и, что очень важно, «бутиковую селекцию» сельскохозяйственных культур, максимально соответствующих среде, поскольку одно хорошо адаптированное растение, выбранное локально за его продуктивность, будет напрямую давать начало успешному сорту.
В противоположность сегодняшним гибридным технологиям мы будем клонировать гетерозисные растения, вернув фермерам их роли новаторов в создании новых сортов, так как они имеют несравнимо большее разнообразие форм, нежели селекционеры. Кроме того, что будут широко использоваться гибриды возделываемых в настоящее время культур, откроется путь к освоению межвидовых и межродовых гибридов. Например, фертильный гибрид пшеницы с овсом вполне реален при бесполосеменном способе размножения.
У гибридов с апомиктическим способом репродукции генетические комбинации, обеспечивающие устойчивость к болезням, абиотическим факторам, насекомым, обычно теряемые при сексуальном размножении, будут поддерживаться вне зависимости от числа поколений.
Апомиксис весьма перспективен, потому что содержит потенциал расширения видов, используемых в гибридной селекции, увеличения урожаев, однородности сортов и значительного снижения стоимости производства гибридных семян.
Первый в мире проект по созданию апомиктичного коммерческого сорта у культурных растений был объявлен и начат в СССР в 1958 году. Его автором был профессор Д.Ф.Петров, создавший для выполнения данного исследования лабораторию цитологии и апомиксиса растений в только что организованном Институте цитологии и генетики СО АН. Однако идея закрепления гетерозиса через размножение, исключающее сегрегацию генов, принадлежит
замечательным ученым, сотрудникам Н.И.Вавилова, М.С.Навашину и Г.Д.Карпеченко, с которыми Д.Ф.Петров работал перед войной в знаменитом ВИРе. Получение апомиктов планировалось на важнейшем сельскохозяйственном объекте — кукурузе. В тот момент обстоятельства максимальным образом способствовали проведению такой работы:
- в связи с агрополитикой Н.С.Хрущева эта культура была в центре внимания официальных органов и широких слоев общества;
- кукуруза была и остается важнейшим объектом гибридных технологий и производства пищевых продуктов во всем мире, поэтому преимущества закрепления гетерозиса были очевидны как для ученых, так и для агрономов;
- в связи с созданием Сибирского отделения Академии наук появилась возможность вести организованную исследовательскую работу методами классической генетики (официально генетика была реабилитирована в конце 1964 года).
В работе, начатой Д.Ф.Петровым, использовали несколько подходов, которые сейчас кажутся наивными, но они вполне соответствовали научным представлениям своего времени. Один из них оказался продуктивным и продолжается в нашей лаборатории, а также в США, Франции, Мексике. В этом исследовании передачу кукурузе (Zea mays L. — Zm) апомиктического способа репродукции осуществляли от ее дикого сородича — трипсакума (Tripsacum dactyloides L. — Td) путем гибридизации. Предполагалось, что генетическая система, контролирующая бесполосеменное размножение, состоит из двух генов:
1) ген апомейоза управляет нередукцией числа хромосом;
2) ген партеногенеза стимулирует развитие эмбриона из яйцеклетки, минуя опыление. Отсюда можно заключить, что для контроля такого типа размножения необходимы максимум две хромосомы дикого сородича, если гены не сцеплены, т.е. расположены в разных хромосомах, и тогда апомиктичная кукуруза будет иметь геном, дополненный двумя хромосомами трипсакума.
Считалось, что присутствие столь незначительного генетического материала от дикого родителя не окажет решающего влияния на фенотип и хозяйственно полезные признаки
апомиктичных сортов.
На основе таких допущений и была начата программа скрещиваний тетраплоидной кукурузы (2n=4х=40, гаплоидный набор хромосом — 10Zm) с тетраплоидным трипсакумом (2n=4х=72, гаплоидный набор — 18Td), имевшим апомиктический способ размножения. В момент начала работ не был известен тип апомиксиса и возможность экспрессии этого признака в F1. К удаче исследователей он оказался доминантным и проявлялся в первом поколении получаемых гибридов.
Позже сотрудницей лаборатории апомиксиса растений ИЦиГ Л.И.Лайковой с коллегами впервые в мире был показан Antennaria-тип апомиксиса (митотическая диплоспория) у трипсакума и его гибридов с кукурузой, подтвержденный затем американскими и французскими исследователями. Это принципиальное наблюдение, так как на его основе стало ясно, что комбинативная изменчивость, связанная с возможным кроссинговером, имеющим место при мейотической диплоспории, в нашем случае исключена, следовательно, все потомки гибридов являются клонами и абсолютными копиями матери.
После получения гибридов первого поколения (2n=56; 20Zm+36Td) встала проблема редукции части генетического материала дикого родителя, не имевшей отношения к контролю признака апомиксиса и удалявшей их по морфологии и хозяйственным признакам от кукурузы. Это достигалось двумя способами:
- отбор редких редуцированных апомиктов и ВII гибридов, получаемых при опылении 56-хромо-сомных растений F1 кукурузой;
- использование более часто встречающихся (около 2-5%) ВIII гибридов для увеличения доли редуцированных апомиктов и ВII гибридов в потомстве.
Редуцированными апомиктами называют потомков, получающихся в результате прохождения мейоза, но развившихся партеногенетически, т.е. без оплодотворения. Так, если гибрид F1 имел 56 хромосом, то редуцированные формы будут иметь 28 (10Zm+18Td). ВII гибриды — это растения, получившиеся после оплодотворения редуцированной яйцеклетки, и их геном зависит от плоидности опылителя — 2n=38 (20Zm +18Td) в случае использования в качестве отцов диплоидов и 2п=48 (30Zm +18Td) при опылении тетраплоидом.
Наконец, ВIII гибриды — это потомки от оплодотворения нередуцированной яйцеклетки, и их геномы могут быть 66- или 76-хромосомными в зависимости от использованного пыльцевого родителя. При дальнейшем беккроссировании такие ВIII гибриды во много раз чаще дают редуцированные апомикты и ВII гибриды, поскольку соотношение геномов полового и апомиктического родителей возрастает в пользу первого, что и приводит к усилению экспрессии признака этого типа размножения у потомков. Далее редуцированные апомикты размножаются бесполосеменным путем, а редуцированные гибриды (ВII) либо апомиктически, либо сексуально в зависимости от набора хромосом трипсакума в их генотипе.
При использовании такого цитогенетического подхода Д.Ф.Петрову с коллегами удалось создать широкий ряд апомиктических гибридных линий с добавлением к разному числу кукурузных геномов гаплоидного набора из 18 хромосом трипсакума. Наиболее стабильными из них были 38-хромосомные (20Zm +18Td). Но они в силу большого количества генетического материала от дикого родителя были далеки от кукурузы, что исключало перспективу их коммерческого использования. В итоге удалось получить несколько дополненных линий кукурузы с 1-2 хромосомами трипсакума, некоторые из которых при тестировании антоциановыми маркерами были квалифицированы как апомикты. Однако специальная проверка с рецессивным маркером shugary (морщинистый эндосперм) не подтвердила этого вывода.
Итак, группа Д.Ф.Петрова успешно получила апомиктичные гибриды, показала доминантный характер наследования апомиксиса и возможности редукции хромосом трипсакума. Ими была создана обширная коллекция апомиктов с различным соотношением геномов кукурузы и трипсакума, и наиболее морфологически близкие к кукурузе имели гаплоидный набор из 18 хромосом дикого родителя, что значительно удаляло их от культурного родителя (рис. 2).
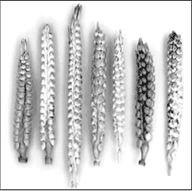
Рис. 2. Початки кукурузно-трипсакумных гибридов:
три слева получены от растения 2n=38 (20Zm + 18Td), два в середине получены от растения 2n=48 (30Zm + 18Td) и два справа получены от растения 2n=58 (40Zm + 18Td).
В 1993 году мы получили предложение Министерства земледелия США провести совместные исследования по апомиктичной кукурузе с использованием нашего экспериментального материала. Кроме того, наш проект был поддержан РФФИ (гранты № 97-04-49301 и 00-04-49542). Работа по совместному проекту была начата весной 1994 года, и сразу же удалось выявить несколько гибридных линий, имевших 39 хромосом (30Zm + 9Td). Результаты гибридологической проверки показали, что они являются апомиктами, это же подтверждалось данными ПЦР (полимеразная цепная реакция) с более чем 60 декануклеотидными праймерами (рис. 3) и единообразием изозимов в беккроссных поколениях. Далее нам удалось установить, что 9 хромосом трипсакума являются минимально необходимыми для поддержания апомиктического способа размножения у гибридов, и потеря любой из них приводит к получению только сексуального типа потомства. Существенным в этих результатах оказалось то, что независимо полученные линии с 9 хромосомами трипсакума как от одного первоначально полученного гибрида F1, так и у редуцированных потомков с 9 хромосомами от других независимых скрещиваний содержали одни и те же хромосомы трипсакума! (рис. 4, 5).
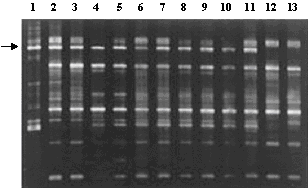
Рис. 3. Результаты ПЦР анализа трипсакума (1), его апомиктичных гибридов с кукурузой различного геномного состава (2-11), сексуального гибрида (12) и материнской линии кукурузы (13). Стрелкой помечена последовательность ДНК, наблюдаемая у всех апомиктов, т.е. маркирующая этот признак.
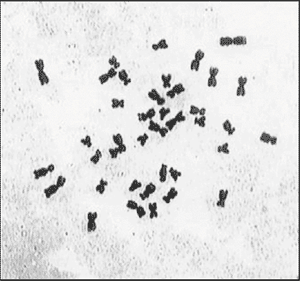
Рис. 4. Кариотип гибрида с 39 хромосомами (30Zm + 9Td).
Отсюда следовало: 1) признак апомиксиса является полигенным и для его контроля необходимы 9 хромосом трипсакума; 2) в дальнейшем работу по апомиктической кукурузе надо строить с учетом этого обстоятельства. Реальность второго вывода наших исследований, казалось, закрывала цель — получение апомиктической кукурузы, так как присутствие 9 хромосом дикого родителя должно было существенно влиять на хозяйственно важные признаки этой культуры, прежде всего вес семян гибридов в граммах (~0,06) был гораздо ближе к таковому у трипсакума (~0,03), чем у кукурузы (~0,22). Кроме того, избыточная кустистость также была нежелательна с точки зрения коммерческой перспективы гибридов. И хотя мы не ставили себе непосредственной целью создание коммерческих сортов, тем не менее должны были вскрыть генетические закономерности апомиктического способа репродукции и наследственные возможности совершенствования гибридов по агрономическим признакам в присутствии 9 хромосом дикого родителя.
Рис. 5. Девять хромосом трипсакума, наблюдаемые у всех апомиктичных гибридов независимо от происхождения.
К сожалению, существуют некоторые особенности при изучении наследования у апомиктов, связанные с отсутствием расщепления у потомков. Это обстоятельство весьма осложняет обсуждение задач исследования и результатов с коллегами и, что особенно печально, с экспертами при получении грантов. Процесс получения генетических результатов при работе с апомиктами более длительный, чем с другими культурами. Так, для того чтобы разрешить старый спор относительно сцепления апомейоза и партеногенеза, пришлось провести обширную программу скрещиваний кукурузы с трипсакумом. Дело в том, что многие исследователи до сих пор считают, что эти составляющие апомиксиса являются одним локусом. Мужской мейоз у трипсакума протекает нормально, поэтому возможен кроссинговер и расщепление, чем мы и воспользовались. Скрестив несколько десятков растений кукурузы с трипсакумом, мы получили 46-хромосомные гибриды (10Zm+36Td), которые были опылены пыльцой культурного родителя. Результаты этого анализа следующие:
- 15 семей с числом потомков от 8 до 15 растений были апомиктами;
- 7 семей с числом потомков от 9 до 17 растений имели по одному ВIII гибриду и лишь одна из них — три ВIII гибрида;
- одна семья (15 растений) состояла только из ВIII гибридов.
Этот результат однозначно говорит о независимом генетическом контроле признаков нередукции и партеногенеза у трипсакума. Кроме того, отсюда и из других наших данных, которые здесь не приводятся, можно сделать вывод о монолокусном контроле апомейоза и полигенном — партеногенеза.
Таким образом, наши результаты существенно изменили представления о генетическом контроле диплоспорического апомиксиса у трипсакума и его гибридов с кукурузой. Как цитогенетические, так и генетические данные говорят о его сложном контроле многими генами. Следовательно, программа работы по совершенствованию линий с добавлением 9 хромосом трипсакума, сформулированная нами, является верной, и усилия по генно-инженерному пути создания апомиктов, начатые в некоторых лабораториях, не имеют ясных перспектив, так как не известны необходимые гены, их число, и нет стратегии их передачи и организации экспрессии в нужное время в нужном месте.
Понимая, что апомиктичные гибриды должны будут конкурировать за рынок с кукурузой, мы провели сравнительный анализ признаков, по которым они превосходят ее. К таковым необходимо отнести:
- урожай зеленой массы;
- высокую фуражную ценность зеленой массы и содержание протеина в ней;
- содержание перевариваемых компонентов в зеленой массе;
- содержание полиненасыщенных жирных кислот в семенах;
- толерантность к засушливым и переувлажненным почвам.
Эти несомненные преимущества позволили бы уже сейчас успешно бороться за коммерческое использование гибридов в качестве фуражной культуры, но их полная мужская стерильность пока остается преградой на этом пути. С целью получения потомков от гибридов приходится высевать в качестве опылителя кукурузу, как правило, в 4-5 сроков, с недельным интервалом между ними, что несложно делать в полевом опыте, но совершенно нетехнологично в производстве. Поэтому выяснение механизмов мужской стерильности будет приоритетной проблемой в ближайшее время. Подобная проблема была и с женской фертильностью. Первоначально выделенные 39- и 49-хромосомные линии имели фертильность не более 3-5% на початок (рис. 6). Нам удалось выяснить, что в значительной степени это связано с особенностями роста пыльцевых трубок (рис. 7) при опылении (гаметофитная несовместимость и нарушения направления роста). Подбором опылителей и других факторов удалось добиться 50% фертильности (рис. 6), что с учетом многопочатковости гибридов делает их вполне конкурентоспособными с кукурузой по продуктивности. Вместе с тем в ближайшее время мы надеемся выяснить и устранить другие причины, снижающие женскую фертильность. Как показал предварительный анализ, один из главных факторов, обусловливающих ее, — импринтинг.
Как мы уже отмечали ранее, импринтинг — это специфическое маркирование геномов при формировании генеративных клеток, детерминирующее активность действия некоторых генов в развитии. При этом женские и мужские гаметы импринтируются по-разному и, соответственно, их геномы вносят разный вклад в проявление признаков, в частности число делений оплодотворенной центральной клетки (и как следствие размер эндосперма) зависит от взаимодействия генов, импринтированных при созревании женских и мужских гамет. Женские импринтированные гены подавляют деления, мужские, напротив, стимулируют, т.е. увеличивают размер зерновки.

Рис. 6. Слева направо: обычный 39-хромосомный гибрид (30Zm + 9Td); продвинутая форма с ~50% женской фертильностью (30Zm + 9Td); родительская форма кукурузы.
Для нормального развития эндосперма у растений, размножающихся половым путем, необходимо соотношение женских и мужского геномов 2 : 1 соответственно, в ином случае он не развивается, что приводит к абортивности зародыша. Здесь важно отметить, что это правило, являющееся абсолютным для кукурузы, не работает строго у апомиктов.
У кукурузы импринтируемые гены, действие которых в сильной степени сказывается на развитии эндосперма и его размере (следовательно, и на урожае!), локализованы в основном в хромосомах 5, 4 и 10. Особенно значительным эффектом на величину эндосперма обладает хромосома 5. Поэтому созданная нами линия гибрида, имеющая в качестве дополнительной эту хромосому (21Zm + 18Td), дает вес семян (~ 0,11; рис. 8) в два раза больший, чем 38-хромосомные (20Zm + 18Td).
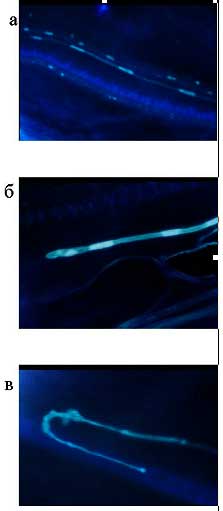
Рис. 7. Рост пыльцевых трубок: а — нормальный рост; б — остановка роста; в — потеря таксиса и обратный рост.
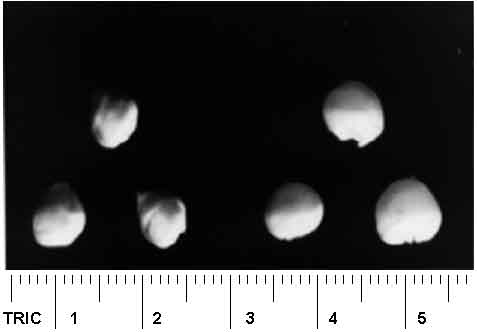
Рис. 8. Эффект хромосомы 5 на размер семян: слева 39-хромосомное растение (20Zm + Zm5 + 18Td), опыленное тетраплоидом, справа семена материнской тетраплоидной кукурузы.
Итак, в результате работы по проекту РФФИ показана сложность генетического контроля апомиктического развития, вскрыты механизмы женской стерильности бесполосеменных гибридов и показаны пути ее преодоления. Изучены генетические механизмы импринтинга и пути повышения продуктивности апомиктичных гибридов с использованием этого эффекта. Получен патент США — «Апомиктичная кукуруза» за № 5,710,367, зарегистрированный в 11 других странах. Но самое главное, создана огромная коллекция апомиктичных линий, которая может быть использована как исходный материал в чисто академических исследованиях различных аспектов апомиктического развития от генетики до эмбриологии и в практической работе по созданию коммерческих сортов.
К великому сожалению авторов, сибирский климат является существенным препятствием в нашей работе, так как время вегетации наших линий около 4 месяцев, безморозный период в Новосибирске — 100-110 дней. Но более всего угнетает финансовый «климат», и данная работа не могла быть выполнена без поддержки Министерства земледелия США и гранта Международного центра размножения растений (Нидерланды № 047.007.019).
Авторы приносят искреннюю благодарность РФФИ (грант № 00-04-49542), а также всем, оказавшим материальную поддержку данного исследования, и многочисленным коллегам в США, Европе, Австралии за постоянное внимание и дискуссии, которые помогали нам в работе.
В.А.Соколов, д.б.н., зав. лабораторией цитологии и апомиксиса растений ИЦиГ СО РАН, Новосибирск
И.С.Хатыпова, н.с., ИЦиГ СО РАН, Новосибирск

