Основными причинами невысокой урожайности гречихи являются гетеростилия, приводящая к иллегитимному, менее результативному опылению, восприимчивость к болезням и полегаемость. Достаточно полно требованиям сельского хозяйства отвечают сорта, обладающие резистентностью, высокоустойчивостью к полеганию и самосовместимостью. Большинство из этих свойств характерно для Fagopyrum tataricum, но, в отличие от посевной, дикорастущая гречиха имеет мелкие зерна и низкоурожайна. Гибриды, полученные путем интрогрессивных скрещиваний, могли бы обладать вышеперечисленными свойствами.
Благодаря работам, начатым А.С.Кротовым и Е.Г.Драненко [1], преодолена резко выраженная у гречихи межвидовая несовместимость и создан при использовании диких видов Fagopyrum cymosum и Fagopyrum tataricum амфидиплоид Fagopyrum giganteum, урожайный, но обладающий не очень высокой фертильностью. Созданные на основе редких морфобиотипов гибриды являются носителями тех признаков, использование которых обеспечивает формирование высокой урожайности. Однако при скрещивании культурных и диких видов гречихи наиболее остро стоит проблема межвидовой несовместимости, чем и объясняется сравнительно низкая фертильность полученных гибридов. В связи с этим на начальном этапе работ по отдаленной гибридизации при подборе исходных родительских пар наряду с кариологической характеристикой важное значение имеет биохимическая характеристика компонентов растительной клетки, участвующих в межклеточном и тканевом узнавании. К числу таких биополимеров, в первую очередь, относятся углеводсвязывающие и углеводсодержащие белки — лектины, которые участвуют в образовании ферментных, полисахаридных и липополисахаридных комплексов, обусловливая тем самым совместимость. Лектины участвуют также в реакциях биоузнавания, в регуляции клеточного деления и дифференциации клеток и тканей [2]. Есть данные об участии лектинов в защитных реакциях растений к фитопатогенам [3-5]. Присутствие лектинов в составе белков эндосперма гречихи [6, 7] позволяет при использовании комплексных биохимических методов изучать их с целью подбора совместимых родительских форм среди посевной и дикорастущей гречихи.
Как известно, по многим параметрам для генетического маркирования зерновых наиболее эффективны и практичны белки семян [8]. Лектины могут быть использованы в качестве маркеров для идентификации генотипа. Сведения о природе лектинов, используемых в генетическом и филогенетическом анализе растений гречихи, в литературе практически отсутствуют.
Целью настоящей работы было изучение количественного содержания, иммунохимической специфичности и гемагглютинирующей активности лектинов посевной и дикорастущей гречихи в связи с проблемой межвидовых скрещиваний и влиянием на содержание и активность лектинов семян и хлорофилл-белковых комплексов листьев гречихи природного биорегулятора Гуми (Гуми-20 и Гуми-М).
Таблица 1
| Гемагглютинирующая активность и содержание лектинов в семенах посевной и дикорастущей гречихи | |||
|
Виды, сорта, каталожные номера ВИР |
Активность лектинов |
Содержание |
|
|
Fagopyrum esculentum |
с. Сокуровская к-4442 |
20,6±1,7 |
0,94 ± 0,07 |
|
с. Бирская |
15,4±1,5 |
0,73±0,05 |
|
|
Fagopyrum sagittatum Gilib |
|
13,1±1,4 |
1,14±0,09 |
|
Fagopyrum tataricum |
к-7 |
27,6±2,1 |
1,82±0,18 |
|
к-14 |
22,4±1,8 |
1,63±0,17 |
|
|
к-20 |
20,5±1,7 |
1,34±0,15 |
|
|
к-10 |
33,4±2,3 |
1,28±0,14 |
|
|
к-21 |
29,3±1,9 |
2,41±0,18 |
|
|
к-66 |
26,5±1,8 |
1,62±0,17 |
|
|
к-77 |
35,6±2,4 |
2,5±0,19 |
|
|
к-107 |
32,3±2,1 |
2,7±0,20 |
|
|
к-67 |
31,0±2,0 |
2,43±0,19 |
|
Изучение количественного содержания лектинов методом твердофазного иммуноферментного анализа показало, что в семенах различных образцов F. tataricum содержание их выше, чем у F. esculentum (табл. 1). При выделении и фракционировании лектинов аффинной хроматографией на овогеле [9] и колонке с сефадексом G 100 нами установлено, что посевная гречиха имеет больше изоформ, чем дикорастущая.
Наиболее полно отражают степень совместимости исходных родительских пар при межвидовых скрещиваниях иммунологические различия, так как по характеру спектров преципитации белков можно судить о генетическoй близости изучаемых видов [8]. Для иммунохимического анализа лектинов были получены специфичные к ним антитела.
Иммунизацию проводили по методике Конарева и др. [10] с некоторыми модификациями. Для получения сывороток с высоким титром нами разработан новый прием иммунизации препаратами очищенных лектинов, эмульгированных в жидком гомополисахариде. Кроликов иммунизировали лектинами, выделенными последовательной экстракцией 0,2 М NaCl и 0,1 М HCl с добавлением 1% триптона Х-114 и саркозилата Na с последующей очисткой на овогеле, диализом и концентрированием на фильтрах из стекловолокна. Полученные таким способом тотальные препараты, содержащие как растворимые, так и структурносвязанные лектины, вводили животным подкожно трижды с недельным интервалом в виде эмульсии с жидким гомополисахаридом и с полным адъювантом Фрейнда. Такой метод иммунизации позволил получить высокоочищенные, с высоким титром антитела к лектинам.
В результате иммунохимического анализа была установлена специфичность лектиновых фракций гречихи посевной и гречихи татарской. В реакциях иммунодиффузии наибольшее число общих антигенов выявлено сывороткой на лектины гречихи посевной в следующих образцах Fagopyrum tataricum: к-77, к-21, к-10 и к-7 (рис. 1).
Se

Рис. 1. Спектры преципитации лектинов из семян гречихи посевной и гречихи дикорастущей. Проявлены антисывороткой на лектины F. esculentum к-4442 (Se).
1 — лектины F. tataricum к-7; 2 — лектины F. esculentum к-4442; 3 — лектины F. tataricum к-21;
4 — лектины F. tataricum к-77; 5 — лектины F. esculentum к-2829; 6 — лектины F. tataricum к-10.
Полученные данные по гемагглютинирующей активности лектинов гречихи посевной и дикой позволили выяснить, что образцы F. tataricum обладают этой активностью в наибольшей степени (табл. 1). Лектины гречихи посевной агглютинируют эритроциты человека 0 (I) группы крови в концентрации, превышающей лектины F. tataricum в несколько раз. Высокая лектиновая активность обнаружена у образцов F. tataricum к-77, к-10, к-107 и
-67, из которых первые два имеют наибольшую гомологию по спектрам преципитации с лектинами F. esculentum. В реакциях иммунодиффузии при проявлении антисывороткой на лектины F. esculentum (к-4442) из исследованных нами образцов дикорастущей гречихи, кроме к-77 и к-10, идентичность по спектрам лектинов с посевной гречихой проявили образцы к-21 и к-7, что говорит об их генетической близости с культурной гречихой. Таким образом, на основании данных иммунохимических реакций и гемагглютинирующей активности лектинов можно провести подбор исходных совместимых форм F. tataricum с целью гибридизации их с гречихой посевной.
У этих же образцов были исследованы лектины из генеративных органов. Обнаружены значительные различия по гемагглютинирующей активности у лектинов пыльников и пестиков. Так, лектины пестиков у образцов F. tataricum к-77, к-21, к-10 и к-7 характеризуются высокой гемагглютинирующей активностью, близки по уровню активности между собой и с лектинами пыльников F. esculentum. Лектины из этих же органов у образцов к-107, к-67, к-14, к-20 проявляют сравнительно низкую активность. Возможно, что уровень гемагглютинирующей активности лектинов генеративных органов имеет немаловажную роль в процессе оплодотворения. Наличие эритроагглютининов в экстрактах женских генеративных органов и влияние лектинов на прорастание пыльцы показаны в экспериментах Е.Л.Голынской [11].
Наряду с исследованиями по выявлению совместимых родительских форм среди диких и культурных образцов гречихи по антигенной близости нами было изучено влияние природного биорегулятора Гуми на некоторые физиолого-биохимические показатели листьев гречихи. Наиболее традиционными объектами при изучении действия биорегуляторов на растения являются фотосинтез и пигментные комплексы, участвующие в этом процессе. В связи с этим исследовали влияние природного биорегулятора Гуми на хлорофилл-белковые комплексы (ХБК) листьев гречихи. Обнаружены различия по гемагглютинирующей активности и содержанию лектинов в ХБК листьев между образцами диких и культурных видов гречихи. Более высокой абсорбционной активностью обладают лектины ХБК гречихи посевной, в них также выше содержание хлорофилла a. Исследование растений, подвергнутых обработке Гуми, показало, что этот биорегулятор влияет на те же этапы метаболизма растений, которые сопряжены с изменением активности лектинов протопластов, хлорофилл-белковых комплексов и оптических свойств листьев. Последние, то есть оптические параметры листьев, отражают функциональное состояние хлорофилла и позволяют определить его количество. В работе нами был использован лазерный спектрофотометр Лафот, который дает возможность измерить долю поглощения, пропускания и отражения энергии излучения без повреждения растения и нарушения функций листа [12]. Установлено, что в листьях растений гречихи после воздействия Гуми увеличивается количественное содержание хлорофилла а в хлоропластах, возрастает коэффициент поглощения (Ab%) лазерного излучения ХБК, изменяется спектр диффузного отражения (Rd%). Установлено, что чем больше хлорофилла а в листьях, тем меньше значение коэффициента отражения. Под влиянием биорегулятора Гуми меняется гемагглютинирующая активность хлоропластных лектинов (табл. 2, рис. 2). Это допускает возможность регулирования лектинами функциональной активности хлоропластов. Известно влияние лектинов на фотофосфорилирование, которое определяется взаимодействием лектина с углеводными остатками на поверхности тилакоидов. Образование лектин-рецепторного комплекса на тилакоидах существенно влияет на процесс фотосинтеза [13].
Таблица 2
| Влияние биорегулятора Гуми на гемагглютинирующую активность, содержание хлорофилла и абсорбцию света ХБК листьев гречихи | ||||
|
Образцы и варианты опыта |
Титр РГА |
Содержание хлорофилла |
Абсорбция Аb% |
|
|
F. tataricum к-77 |
контроль |
1 : 6 |
6,7±0,20 |
81,4±0,60 |
|
опыт* |
1 : 10 |
8,9±0,34 |
83,2±0,70 |
|
|
F. tataricum к-21 |
контроль |
1 : 5 |
5,8±0,18 |
81,0±0,50 |
|
опыт |
1 : 9 |
8,0±0,30 |
82,3±0,64 |
|
|
F. esculentum, с. Сокуровская |
контроль |
1 : 4 |
7,8±0,26 |
83,5±0,72 |
|
опыт |
1 : 7 |
10,2±0,42** |
86,2±0,86 |
|
|
А. esculentum G., с. Бирская |
контроль |
1 : 3 |
7,2±0,24 |
82,4±0,64 |
|
опыт |
1 : 6 |
9,7±0,36 |
85,0±0,80 |
|
* Обработка растений Гуми из расчета 300 г/га; ** значимо на 5% уровне.
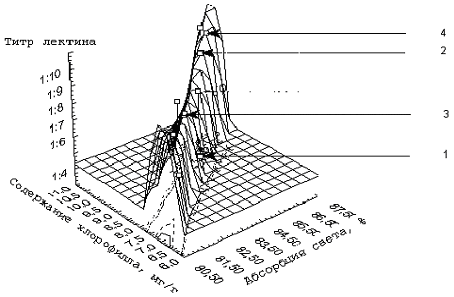
Рис. 2. Зависимость гемагглютинирующей активности лектинов, содержания хлорофилла и абсорбции света ХБК от воздействия биорегулятора Гуми.
1 — F. esculentum — контроль; 2 — F. esсulentum — опыт; 3 — F. Tataricum — контроль; 4 — F. tataricum — опыт
При обработке растений Гуми происходит резкое увеличение титра гемагглютинации лектинов и улучшаются абсорбционные свойства ХБК как у посевной, так и у дикорастущей гречихи. Однако, если у F. tataricum резко увеличивается эритроагглютинирующая активность лектинов, то у F. esculentum возрастает коэффициент абсорбции.
Выявленная видовая специфичность лектинсодержащих фракций белков семян гречихи дает возможность использовать их в качестве маркеров в селекционно-генетических исследованиях. Гуминовые кислоты, являющиеся природными биорегуляторами, изменяют активность лектинов хлоропластов, что стимулирует фотосинтетическую активность листьев, влияя на оптические свойства хлорофилл-белковых комплексов.
Литература
- Кротов А.С., Драненко Е.Т. Амфидиплоид гречихи // Бюлл. ВИР. 1973. Вып. 3. С. 41-44.
- Королев Н.П. Функции лектинов в клетке // Общие проблемы физико-химической биологии. Итоги науки и техники. Т. 1. М.: Наука, 1984. 351 с.
- Ямалеев А.М., Мелентьев А.И., Ямалеева А.А. О значении лектинов в защитной реакции растений пшеницы к пыльной головне // С.-х. биология. 1988. № 5. С. 43-44.
- Milerman D., Galun E., Sharon N., Lotan R. Inhibition of fungal growth by wheat germ agglutinin // Nature. 1975. V. 256, № 1. P. 414-416.
- Jamalejeva A.A. Lectin function in resistance of wheat to fungi diseases // 13-th Intern. Lectin Meet. Interlec 13. Ber-lin, 1991. Р. 67.
- Axiki C.C., Bourboure K., Luporsi C., Percheron F., 1980. Цит. по: Лахтин В.М. Лектины в исследовании белков и углеводов. M.: ВИНИТИ АН СССР, 1987. Т. 2. 288 с.
- Ямалеева А.А. Влияние природных регуляторов роста и развития на экспрессию генома хлоропластов гречихи и проса // Материалы II съезда ВОГиС. 2000. Т. 1. С. 93.
- Конарев В.Г. Морфогенез и молекулярно-биологический анализ растений. Санкт-Петербург: ВИР, 1998. 370 с.
- Луцик М.Д. Новый аффинный сорбент для очистки лектинов // Укр. хим. журн. 1984. Т. 56, № 4. С. 432-436.
- Конарев В.Г., Гаврилюк И.П., Губарева Н.К. Белковые маркеры геномов пшениц и их диких сородичей // Вестн. с.-х. науки. 1970. № 8. С. 100-114.
- Голынская Е.П. Исследование лектинов генеративных органов примулы обратноконической // Мол. биол. Киев, 1979. № 3. С. 34-38.
- Лискер И.С. Лазернооптические методы, устройства и системы автоматизированного исследования растений и семян: Сб. тр. АФИ. Санкт-Петербург, 1997. С. 321.
- Филиппов В.В. Реакции узнавания и устойчивость // Ржавчина пшеницы. М.: Наука, 1989. С. 233-250.
А.А.Ямалеева, к.б.н., доцент, кафедра биохимии и биотехнологии Башкирского госуниверситета, г. Уфа

