Не обнаружено соответствия между частотой опухолей, развивающихся у мышей разного генотипа и пола при введении гепато- и пульмоноканцерогенов в подсосном периоде, и частотой перестроек хромосом, вызываемых ими в клетках печени и легких в ранние сроки (через сутки) после введения. В тесте Эймса и SOS-хромотесте генотоксичные канцерогены (диэтилнитрозамин, орто-аминоазотолуол) активировались ферментами печени и легких чувствительных и резистентных к индукции опухолей животных одинаково эффективно. Немутагенный уретан вызывал в 13-40 раз больше опухолей, чем ?-облучение дозой 4 Гр. Сделан вывод, что у подсосных мышей механизм индукции опухолей печени и легких не генотоксический.
Введение
В злокачественных опухолях человека и животных часто обнаруживаются множественные генетические нарушения — различные хромосомные перестройки и генные мутации. Некоторые из них специфически приурочены к определенным видам опухолей (например, так называемая филадельфийская хромосома — к миелоидному лейкозу, делеции в 4-й хромосоме — к мезотелиомам и мелкоклеточным опухолям легких человека [1], мутации в генах H-ras — к опухолям печени мышей и крыс [2] и т.д.). На клеточных культурах показано, что трансфекция клеток онкогенами может вызывать их трансформацию и что протоонкогены часто превращаются в онкогены в результате определенных — активирующих — мутаций. Все эти факты, а также наследственный характер изменений, происходящих при малигнизации, казалось бы, однозначно свидетельствуют о том, что канцерогенез связан с мутациями в клеточных онкогенах и/или антионкогенах, а канцерогены так или иначе эти мутации вызывают [3-6]. Отсюда следует, что о канцерогенности соединения можно судить по его мутагенной активности. Для оценки последней было предложено множество тестов с использованием бактерий, дрозофил, дрожжей, грибов Neurospora и Fusarium и др., однако после того как было установлено, что многие канцерогены приобретают способность индуцировать опухоли в процессе метаболической активации в организме, стало ясно, что совпадение канцерогенности соединения и его мутагенной активности в подобных тестах может быть лишь случайным. С учетом этого Б.Эймсом и др. [4] был разработан бактериальный тест для количественной оценки потенциальной мутагенности химических соединений с использованием для их активации клеточных ферментов (S9-фракции) печени крыс, предобработанных индукторами цитохрома Р450. Этот метод (тест Эймса), получивший широчайшее распространение во всем мире, позволил выявить огромное количество потенциально вредных мутагенных веществ. Однако при использовании этого метода сильные канцерогены зачастую проявляют слабую мутагенность, тогда как многие неканцерогенные вещества оказываются активными мутагенами. Так, в пересчете на мкмоль вещества диэтилнитрозамин (ДЭНА) вызывает опухолей в 1000 раз больше, чем мутаций, а 3,4-бенз(![]() )пирен — мутаций в 2000 раз больше, чем опухолей [7-9]. Причиной такого несоответствия могут быть различия в метаболизме указанных соединений, неактивных per se, в печени подсосных мышат, на которых изучена их канцерогенная активность, и в тесте Эймса, в котором для активации использовались микросомальные ферменты печени крыс, индуцированных ароклором 1254. Индукторы этого типа увеличивают активность монооксигеназ печени в десятки и сотни раз по сравнению с исходной [10], поэтому если у дрожжей и дрозофил многие канцерогены не проявляют мутагенности вследствие неспособности активироваться их ферментными системами, то в тесте Эймса, в его традиционной постановке, даже канцерогенные для печени крыс вещества «показывают» не то, что они «делают» в ткани-мишени, а то, на что способны при определенных особых условиях. В еще большей степени это относится к канцерогенам, вызывающим опухоли в непеченочных тканях, каждая из которых имеет свой специфический набор изоферментов цитохрома Р450, различающихся по активности, субстратной специфичности и индуцибельности эндогенными и средовыми индукторами [10]. Следовательно, канцерогены, требующие метаболической активации, должны испытываться на мутагенность на тех же животных и в тех же тканях, в которых они вызывают развитие опухолей, а в случае применения бактериальных тестов — с использованием для их активации ферментов именно этих тканей.
)пирен — мутаций в 2000 раз больше, чем опухолей [7-9]. Причиной такого несоответствия могут быть различия в метаболизме указанных соединений, неактивных per se, в печени подсосных мышат, на которых изучена их канцерогенная активность, и в тесте Эймса, в котором для активации использовались микросомальные ферменты печени крыс, индуцированных ароклором 1254. Индукторы этого типа увеличивают активность монооксигеназ печени в десятки и сотни раз по сравнению с исходной [10], поэтому если у дрожжей и дрозофил многие канцерогены не проявляют мутагенности вследствие неспособности активироваться их ферментными системами, то в тесте Эймса, в его традиционной постановке, даже канцерогенные для печени крыс вещества «показывают» не то, что они «делают» в ткани-мишени, а то, на что способны при определенных особых условиях. В еще большей степени это относится к канцерогенам, вызывающим опухоли в непеченочных тканях, каждая из которых имеет свой специфический набор изоферментов цитохрома Р450, различающихся по активности, субстратной специфичности и индуцибельности эндогенными и средовыми индукторами [10]. Следовательно, канцерогены, требующие метаболической активации, должны испытываться на мутагенность на тех же животных и в тех же тканях, в которых они вызывают развитие опухолей, а в случае применения бактериальных тестов — с использованием для их активации ферментов именно этих тканей.
В представленной работе мы предприняли попытку сопоставить количественно онкогенный и мутагенный эффекты ряда химических канцерогенов и гамма-излучения в печени и легких подсосных мышей, у которых однократного воздействия этими агентами оказывается достаточно для индукции опухолей. Полученные результаты показывают, что частота и множественность опухолей, развившихся у мышей через 10-12 месяцев после воздействия канцерогенами, не соответствуют частоте вызываемых ими в острой фазе аберраций хромосом и не связаны количественно со способностью ферментов печени и легких активировать канцерогены до мутагенных производных.
Материалы и методы
В опытах использованы мыши линий CBA/LacSto (CBA) и ICR, полученных из вивария Института цитологии и генетики СО РАН. Животные содержались в условиях естественного освещения, получая натуральные корма и воду ad libitum. Использованные в работе канцерогены были получены из фирм «Fluka» и «Serva» или синтезированы в Институте органической химии СО РАН. В экспериментах по индукции опухолей канцерогены вводили 12-15-дневным мышатам обоего пола внутрибрюшинно из расчета 0,01 мл раствора на 1 г массы тела. Дозы препаратов составляли: уретана — 500 мкг/г, орто-аминоазотолуола (ОАТ) — 225 мкг/г, этилметансульфоната (ЭМС) — 200 или 100 мкг/г, ДЭНА — 40 мкг/г массы тела животных. Других мышат этого возраста подвергали общему ?-облучению в дозе 4 Гр на установке ИГУР-1 с Се138элементом при мощности дозы 1,46 Гр/мин. В месячном возрасте мышат отсаживали от родителей и содержали (самцов и самок отдельно) в течение еще 9-11 месяцев. По истечении этого срока животных умерщвляли декапитацией, вскрывали и исследовали визуально на наличие опухолей. Опухоли печени учитывали как принято [7], подсчитывая выступающие и более плоские сероватые образования, гистологически являющиеся гиперпластическими узелками и гепатомами разной степени дифференцированности и злокачественности (см. рисунок). Пораженные опухолями ткани фиксировали в 10%-м формалине для гистологического анализа. Опухоли (поверхностные аденомы) легких подсчитывали на фиксированном органе под бинокулярной лупой. При оценке мутагенного действия канцерогенов в тканях in situ их вводили 12-дневным мышатам в таких же (ОАТ, ЭМС) или больших, чем при индукции опухолей, дозах (уретан, 1000 мкг/г). Через 20 часов после введения препаратов мышат умерщвляли декапитацией и фиксировали в жидкости Карнуа с последующей заменой фиксатора 70%-м этиловым спиртом. Мутагенный (кластогенный) эффект оценивали по перестройкам хромосом в клетках, завершающих первый митоз после воздействия, на зашифрованных давленых препаратах, окрашенных ацетокармином. При этом учитывали общее число клеток в стадиях анафазы и ранней телофазы и среди них число клеток с хромосомными мостами и фрагментами. В каждой ткани одного животного исследовали по 200-250 митозов.

Рис. Внешний вид печени 12-месячных самцов (верхний ряд) и самок (нижний ряд) мышей линии CBA, получавших в 12-дневном возрасте однократную инъекцию уретана в дозе 1 мг/г массы тела. Видны множественные поверхностные опухоли у самцов и отсутствие их у самок.
Способность клеточных ферментов легких и печени мышей активировать ДЭНА и уретан до мутагенных продуктов изучали в SOS-хромотесте с использованием штамма бактерий E.coli PQ37, любезно предоставленного нам доктором Quillardet. Анализ проводили по стандартной методике [11] с некоторыми модификациями, рекомендованными в работе [12]. В каждом случае испытано по 5 доз препарата. S9-фракцию печени и легких получали, центрифугируя 25%-е гомогенаты тканей в 1,15%-м КСl (10 минут при 9 тыс. g), и хранили до использования в жидком азоте. Негативным контролем служила не содержащая бактерии активационная среда с S9-фракцией или без нее, а позитивным — заведомо мутагенные 4-нитрохинолин-N-оксид (0,1-0,2 мкг на анализ) в экспериментах без метаболической активации и 3,4-бензпирен (БП; 2,5 мкг на анализ) в экспериментах с активацией. Кроме того, в качестве положительного контроля использовали S9-фракцию печени крыс, индуцированных ароклором 1254. Для количественного выражения мутагенности испытанных в тесте соединений использовали показатель «фактор индукции» (FI), величину которого определяли по формуле: FI=R(C)/R(O), где R(C) — отношение активности ?-галактозидазы к активности щелочной фосфатазы в опыте, а R(O) — в контроле (в отсутствие тестируемых веществ).
Мутагенную активацию ОАТ изучали в тесте Эймса на штамме S. typhimurium ТА98 по стандартной прописи [13] с использованием S9-фракций из печени интактных 12-дневных мышат и в качестве положительного контроля — взрослых мышей линии C57BL, индуцированных фенобарбиталом (трижды по 80 мг/кг в день) или ароклором 1254 (400 мг/кг за 5 суток до забоя). Позитивным контролем на мутагенность служил также БП. Канцерогены растворяли в диметилсульфоксиде (ДМСО) и использовали в оптимальной дозе, которая составляла 2,5 мкг на чашку. В каждой постановке теста был негативный контроль, в котором вместо канцерогенов добавляли ДМСО (10 мкл на чашку). Колонии подсчитывали через 48 часов инкубации при 37оС. Статистическую обработку результатов, полученных в SOS-хромотесте, проводили с помощью однофакторного дисперсионного анализа с использованием программы MS Exel 7,0; достоверность различий между средними по частоте опухолей оценивали с помощью arcsin-преобразования Фишера, а в остальных случаях — с помощью t-критерия Стьюдента.
Результаты
К 12-месячному возрасту (моменту окончания экспериментов) спонтанные опухоли печени были зарегистрированы у половины самцов и более чем у трети самок мышей линии СВА, что хорошо согласуется с данными, полученными ранее [14], тогда как опухоли легких не были обнаружены ни у самцов, ни у самок (табл. 1). У мышей ICR опухоли печени регистрировались значительно реже (у 12,9% самцов и отсутствовали у самок), а аденомы легких — чаще (у трети самцов и более чем у 10% самок), чем у мышей СВА. У мышей обеих линий, таким образом, в особенности у самцов, имеется выраженная предрасположенность к развитию опухолей печени, а у ICR — еще и опухолей легких. Введение канцерогенов в подсосном периоде привело к тому, что к концу экспериментов частота опухолей у животных обеих линий увеличилась, хотя и в неодинаковой степени у самцов и самок и при действии разных канцерогенов (табл. 1). Наиболее активным канцерогеном по отношению к печени оказался ДЭНА, лишь незначительно уступал ему в этом отношении уретан. ОАТ на данной модели оказался относительно слабым канцерогеном, уступающим по активности как ДЭНА, так и уретану. Еще меньшую гепатоканцерогенную активность показал ЭМС, проявивший, однако, выраженную канцерогенность для легких. Что касается облучения, то оно практически не повлияло на частоту опухолей печени у мышей обеих линий: некоторое снижение ее у самок СВА и повышение у мышей ICR статистически недостоверно.
Таблица 1
|
Линия |
Пол мышей |
Канцероген,доза, мкг/г |
Опухоли печени |
Опухоли легких |
|||
|
частота, % |
число опухолевых узлов на мышь |
частота, % |
число аденом на мышь |
||||
|
CBA |
самцы |
контроль |
23 |
52,2 |
1±0,5 |
0 |
0 |
|
ICR |
самцы |
контроль |
31 |
12,9 |
0,3 |
32,3 |
0,5±0,2 |
|
CBA |
самцы |
ДЭНА, 40 |
16 |
100 |
59±6,3 |
62,5 |
1,6±0,5 |
|
ICR |
самцы |
ДЭНА, 40 |
9 |
100 |
39±8,7 |
77,8 |
3,0±1,1 |
|
CBA |
самцы |
Уретан, 500 |
10 |
100 |
26,0±4,3 |
90,0 |
4,6±1,3 |
|
ICR |
самцы |
Уретан, 500 |
8 |
100 |
4±1,1 |
100 |
11,6±1,3 |
|
CBA |
самцы |
ОАТ, 225 |
15 |
100 |
12,8±1,8 |
26,7 |
0,3±0,2 |
|
ICR |
самцы |
ОАТ, 225 |
22 |
100 |
5,3±1,5 |
— |
— |
|
ICR |
самцы |
ЭМС, 200 |
25 |
56,0 |
1,4±0,3 |
100 |
8,6±1,6 |
|
CBA |
самцы |
|
12 |
50,0 |
0,6 |
6,73 |
0,1 |
|
ICR |
самцы |
|
14 |
28,6 |
0,3 |
35,7 |
0,6 |
Как и ожидалось, наиболее сильным канцерогеном для легких явился уретан. Несколько уступал ему ЭМС и значительно — ДЭНА, наименее активным был ОАТ. При действии уретана наблюдались и межлинейные различия по чувствительности к индукции опухолей легких (у мышей ICR выше, чем у CBA), противоположные таковым по чувствительности к индукции опухолей печени (у CBA выше, чем у ICR, табл. 1). Чувствительность к индукции опухолей легких в наших экспериментах, за одним исключением, не зависела от пола мышей, что соответствует литературным данным [15]. ДЭНА и ЭМС в канцерогенном отношении действовали на легкие самцов и самок мышей одинаково, тогда как облучение, практически не повлиявшее на частоту опухолей легких у самцов, существенно увеличивало ее у самок мышей обеих линий (табл. 1).
Сведения о частоте клеток с аберрациями хромосом в печени и легких изученных нами мышей суммированы в таблице 2. Поскольку интактные самцы и самки не различались в этом отношении между собой, в таблице данные по ним в пределах каждой линии объединены. В таблице 1 видно, что частота клеток с перестройками хромосом была практически одинаковой в печени и легких у контрольных мышей обеих линий. При введении ДЭНА их частота в печени значительно увеличилась у мышей СВА и в несколько меньшей степени у мышей ICR, а также в легких мышей СВА (ICR не исследовали). Специфический для печени кластогенный эффект, в особенности у самцов, оказывал ОАТ, практически не действующий повреждающе на хромосомы в клетках легких. Уретан не вызывал перестроек хромосом в клетках как печени самцов СВА, у которых он индуцирует множество опухолей печени, так и легких мышей ICR, отвечающих на его действие образованием наибольшего числа аденом. Напротив, облучение и ЭМС вызывали множественные хромосомные аберрации в клетках как печени, так и легких (табл. 2).
Таблица 2
|
Линия |
Пол мышей |
Канцероген,доза, мкг/г |
Печень |
Легкие |
||
|
число мышей |
частота клеток с перестройками хромосом (%) |
число мышей |
частота клеток с перестройками хромосом (%) |
|||
|
CBA |
контроль |
10 |
2,5±0,11 |
9 |
2,5±0,19 |
|
|
ICR |
контроль |
14 |
2,2±0,21 |
10 |
2,4±0,20 |
|
|
CBA |
самцы |
ДЭНА, 40 |
4 |
4,2±0,37*** |
4 |
3,1±0,32 |
|
ICR |
самцы |
ДЭНА, 40 |
7 |
3,6±0,49* |
— |
|
|
CBA |
самцы |
Уретан, 1000 |
10 |
2,9±0,21 |
— |
|
|
ICR |
самцы |
Уретан, 1000 |
6 |
2,5±0,24 |
6 |
2,3±0,27 |
|
CBA |
самцы |
ОАТ, 225 |
4 |
4,7±0,54** |
4 |
2,4±0,28 |
|
ICR |
самцы |
ЭМС, 200 |
6 |
6,1±0,41*** |
6 |
9,1±1,47*** |
|
CBA |
самцы |
|
5 |
6,5±0,74*** |
5 |
8,6±1,40*** |
|
ICR |
|
10 |
11,2±0,88*** |
10 |
13,6±1,05*** |
|
Результаты, полученные при изучении влияния канцерогенов на хромосомы клеток печени и легких in vivo, хорошо согласуются с данными о способности клеточных ферментов печени и легких активировать эти канцерогены до мутагенных продуктов в SOS-хромотесте (табл. 3) и тесте Эймса (табл. 4). Повреждающие хромосомы гепато- и пульмоноцитов ДЭНА и ЭМС в присутствии S9-фракции (а ЭМС и без нее; данные не приведены) вызывали выраженный SOS-ответ независимо от того, из какого органа и от каких мышей эта фракция была получена. В отличие от этого, некластогенный в применяющейся для индукции опухолей и использованной в экспериментах дозе уретан не вызывал SOS-ответа (фактор индукции не превышает 1), то есть не обладал мутагенной активностью при инкубации с любой из S9-фракций, эффективно активирующих ДЭНА. Как видно в таблице 4, в отсутствие активирующих ферментов ОАТ не увеличивает число обратных мутаций в гистидиновом локусе бактерий штамма ТА98 S. typhimurium, то есть сам по себе не обладает способностью вызывать мутации типа сдвига рамки. В присутствии S9-фракции из печени мышей, индуцированных ароклором-1254 (использованы мыши тестерной по индуцибельности линии C57BL), он оказался высокомутагенным (число ревертантов увеличилось более чем в 10 раз по сравнению с контролем). В 6 раз увеличилось число ревертантов при активации ОАТ ферментами печени мышей, индуцированных фенобарбиталом. Что касается активации его ферментами непредобработанных индукторами животных (12-дневных мышат линий CBA и ICR, а также взрослых мышей C57BL), то, как следует из полученных данных, она имеет место, хотя и на значительно более низком уровне (число ревертантов лишь вдвое превышает контрольный уровень, табл. 4). В этом отношении никаких существенных различий, связанных с линейной принадлежностью, полом или возрастом мышей, нами не обнаружено.
Таблица 3
|
Источник S-9 фракции |
Фактор индукции |
||
|
ДЭНА |
ЭМС |
Уретан |
|
|
Печень самок CBA |
2,3±0,19 |
2,9±0,64 |
0,7±0,17 |
|
Печень самцов CBA |
2,8±0,22 |
4,7±0,36 |
0,8±0,13 |
|
Печень самок ICR |
1,9±0,28 |
3,4±0,50 |
0,7±0,18 |
|
Печень самцов ICR |
2,6±0,16 |
2,0±0,08 |
1,0±0,04 |
|
Легкие CBA |
2,0±0,14 |
2,3±0,21 |
0,7±0,13 |
|
Легкие ICR |
2,2±0,11 |
3,3±0,09 |
0,5±0,09 |
|
Примечание. Фактор индукции для бензпирена (положительный контроль) при активации его S9-фракциями из печени исследованных мышей равен 2,7±0,29. |
|||
Таблица 4
|
Доноры S9-фракций |
Число ревертантов |
||||
|
Контроль(ДМСО) |
БП |
ОАТ |
|||
|
число на чашку |
ФИ* |
число на чашку |
ФИ* |
||
|
Без S9-фракции |
33±1,6 |
34±2,1 |
1,0 |
35±1,9 |
1,1 |
|
Взрослые самцы C57BL |
29±1,2 |
78±7,4 |
2,7 |
63±1,3 |
2,2 |
|
Взрослые самцы C57BL, индуцированные фенобарбиталом |
23±0,6 |
144±1,7 |
6,3 |
167±3,2 |
7,3 |
|
Взрослые самцы C57BL, индуцированные ароклором-1254 |
32±1,8 |
285±4,4 |
8,9 |
334±3,1 |
10,4 |
|
12-дневные самцы CBA |
26±0,9 |
88±4,8 |
3,4 |
62±4,9 |
2,7 |
|
12-дневные самки CBA |
22±0,9 |
91±2,5 |
3,9 |
68±3,0 |
3,1 |
|
12-дневные самцы ICR |
22±0,9 |
73±1,0 |
3,3 |
52±2,1 |
2,4 |
|
Крысы, индуцированные ароклором-1254 |
36±2,5 |
128±1,2 |
3,6 |
202±2,3 |
5,6 |
Обсуждение
Гепатоканцерогенез, индуцированный у мышей и крыс ароматическими аминами и азокрасителями, является одной из основных экспериментальных моделей химического канцерогенеза. Использование именно этой модели позволило установить основные закономерности опухолеобразовательного процесса, а также обнаружить такое фундаментальное явление, как метаболическая активация широкого круга применяющихся в эксперименте и средовых канцерогенов [10]. Активированные метаболиты канцерогенов («электрофильные реактанты») характеризуются высокой реакционной способностью и неферментативно взаимодействуют с нуклеофильными атомами клеточных макромолекул. Алкилируя экзоциклические атомы кислорода гуанина и (в меньшей степени) тимина, они способны вызывать ошибки репликации, приводящие к мутациям типа замены оснований и сдвига рамки, а повреждая азотные сайты оснований, приводить в конечном счете к разрывам ДНК. Этот факт и явился решающим аргументом в пользу представлений о генотоксическом механизме действия канцерогенов; видовая и тканевая специфичность, по этим представлениям, определяется тем, образуются ли в данной ткани (или поступают в нее) активированные метаболиты канцерогенов. Последние одинаково эффективно взаимодействуют как с эукариотической, так и с прокариотической ДНК, что и позволяет оценивать их мутагенность в бактериальных тестах [4]. Специфическое распознавание активированными метаболитами канцерогенов определенных генов и взаимодействие исключительно с ними в ущерб остальным в рассматриваемой концепции не предполагается.
Многочисленные исследования, проведенные с использованием бактериальных тестов, показали, что между канцерогенной и мутагенной активностью многих соединений наблюдается положительная корреляция, хотя однозначного соответствия нет [16]. Последнее, однако, может быть неким артефактом, обусловленным тем, что мутагенная активность канцерогенов оценивается без учета видовой и тканевой специфичности их действия. Поэтому только количественное изучение соотношения той и другой для каждого конкретного вещества непосредственно в ткани-мишени может дать ответ на вопрос, связаны ли генотоксичность и канцерогенность причинно, или корреляция между ними является отражением связи не первого порядка.
Для гепатоканцерогенов проведение такого изучения на взрослых животных затруднительно. Это обусловлено тем, что опухоли печени индуцируются у них только при длительном повторяющемся введении канцерогенов, при этом действие каждой последующей дозы протекает на фоне предыдущих, вследствие чего первичные и отдаленные, а также накапливающиеся побочные эффекты канцерогена накладываются друг на друга и не могут быть разграничены [17]. Этих недостатков лишены модели, в которых опухоли индуцируются при однократном воздействии канцерогенами (например, аденомы легких у мышей). Применительно к печени такая модель была разработана после того как было обнаружено, что у самцов мышей, получавших канцерогены в подсосном периоде (на 12-й-15-й дни жизни), к 8-12-месячному возрасту развиваются множественные предопухолевые поражения и опухоли печени [7, 18]. Только в редких случаях и значительно позднее они могут развиться и у самок [19]. Как у самцов, так и у самок при этом развиваются и опухоли легких. В настоящей работе мы оценили в бактериальных тестах способность микросомных ферментов печени и легких 12-дневных мышат, различающихся по чувствительности к различным канцерогенам, активировать эти канцерогены до мутагенных продуктов, а также частоту перестроек хромосом в клетках печени и легких этих мышат через сутки после воздействия данными канцерогенами. Анализ метафазных хромосом в силу крайней редкости митозов в легких и печени мышей было провести затруднительно, поэтому мы оказались перед выбором: оценивать кластогенный эффект канцерогенов in vivo по сестринским хроматидным обменам или по хромосомным перестройкам (мостам и фрагментам) в клетках, находящихся в стадиях анафазы и ранней телофазы первого после воздействия митоза. Поскольку метод сестринских хроматидных обменов требует продолжительного воздействия на животных бромдезоксиуридином, который сам является мутагеном и, возможно, канцерогеном [6]. Мы остановились на учете перестроек хромосом. Оказали влияние на этот выбор и литературные данные, свидетельствующие об отсутствии корреляции между канцерогенной активностью ароматических аминов и азокрасителей и их способностью индуцировать сестринские хроматидные обмены in vivo [20], и о якобы наличии такой корреляции между хромосомными аберрациями в клетках крови и частотой опухолей у человека [21].
В наших экспериментах множественные опухолевые поражения печени развились у 100% мышей-самцов обеих линий, получавших ДЭНА, уретан или ОАТ, что во всех случаях достоверно отличается от контроля, тогда как у самок всех групп процент животных с опухолями увеличился лишь незначительно (табл. 1). Между тем ни по частоте гепатоцитов с перестройками хромосом после острого введения канцерогенов (табл. 2), ни по способности печеночных ферментов к мутагенной активации последних в бактериальных тестах (табл. 3 и 4) самки мышей не отличались от самцов. По современным представлениям, резистентность подсосных самок мышей к действию гепатоканцерогенов определяется на стадии промоции, решающая роль при этом отводится гормональному статусу организма самок (а именно характеру секреции соматотропного гормона) [22]. Однако во взрослом состоянии самки мышей значительно превосходят самцов по чувствительности к гепатоканцерогенам [7, 14]. Так, нами было показано, что самцы линии CC57BR, чувствительные к индукции опухолей печени при введении ОАТ в подсосном периоде [23], устойчивы при введении его во взрослом состоянии [14], тогда как самки, напротив, устойчивы в подсосном периоде и чувствительны во взрослом [14, 23]. В рамках концепции двустадийного канцерогенеза следует полагать, что ОАТ при хроническом применении либо сам промотирует гепатоканцерогенез у самок, либо меняет гормональный статус (в той части, в которой он имеет отношение к промоции гепатоканцерогенеза) животных того и другого пола на противоположный. В качестве альтернативы этому объяснению можно предположить, что у подсосных и взрослых мышей ОАТ вызывает неодинаковую инициацию гепатоцитов, проявляющих чувствительность к промоции в условиях гормонального статуса мужского организма в первом случае и женского — во втором. Определяются ли, таким образом, различия по частоте опухолей у самцов и самок на уровне инициации или промоции — неясно. Поэтому оставим различия между самцами и самками и рассмотрим соотношение между канцерогенной и мутагенной активностью изученных нами соединений только у самцов. И в этом случае, однако, сколько-нибудь отчетливой связи между этими показателями не прослеживается.
Как уже было сказано, наибольшую гепатоканцерогенную активность у мышей обеих линий проявил ДЭНА, заметно повышающий частоту повреждений хромосом в клетках печени и эффективно активируемый их ферментами до мутагенных продуктов в SOS-хромотесте. Однако ОАТ, не уступавший ДЭНА по кластогенной активности, вызвал у мышей СВА в 4,5 раза меньше опухолей печени, тогда как вообще негенотоксичный уретан — лишь в 2,2 раза меньше. Не различаясь между собой по количеству клеток с перестройками хромосом (которое у тех и других было на уровне контроля), мыши СВА и ICR более чем в 6 раз различались по количеству индуцированных уретаном опухолей печени. Уретан, наиболее сильный канцероген для легких, не повышал частоту пневмоцитов с перестройками хромосом (табл. 2) и не активировался клеточными ферментами до мутагенных метаболитов в SOS-хромотесте (табл. 3). В литературе имеются единичные сообщения о том, что уретан вызывает мутации в тесте Эймса [24] и повреждение хромосом в клетках in vitro [25]. Однако наблюдается это только при очень высоких его концентрациях (10 мг/мл культуральной среды и 10-25 мг на чашку в тесте Эймса [24, 25]), более чем на порядок превышающих необходимые для индукции опухолей, и, очевидно, не имеет отношения к их индукции.
Качественно другие закономерности наблюдались нами при использовании заведомо генотоксичных ЭМС и ?-облучения. По числу хромосомных перестроек, индуцированных в клетках печени, они значительно превосходили ДЭНА и ОАТ, не говоря уже об уретане (табл. 2), однако проявляли лишь следовую активность как канцерогены: слабое, хотя и статистически достоверное гепатоканцерогенное действие оказывал ЭМС, введенный в близкой к максимально переносимой дозе (200 мкг/г), тогда как облучение, вызывавшее еще более выраженный кластогенный эффект, в особенности у мышей ICR, не привело к сколько-нибудь значительному повышению частоты или множественности опухолей печени по сравнению с контролем. В то же время для легких ЭМС оказался сильным канцерогеном, а облучение достоверно увеличивало частоту опухолей легких только у самок (табл. 1).
Полученные результаты, таким образом, показывают, что мутагенная активность, проявляемая гепато- и пульмоноканцерогенами в тканях-мишенях, не отражает их канцерогенного потенциала в этих тканях. Поэтому наблюдавшееся многими исследователями несоответствие между канцерогенной активностью соединений и их мутагенностью в тесте Эймса не является результатом того, что последняя была неадекватно (без учета тканевой специфичности действия канцерогенов) оценена, а, очевидно, означает, что такого соответствия нет по существу. Действительно, канцерогенов, не проявляющих мутагенной активности ни в одном из известных тестов, в настоящее время так много, что их пришлось выделить в особую группу так называемых эпигенетических канцерогенов [26]. Однако признание наличия таких канцерогенов по существу означает признание неуниверсальности генотоксического механизма канцерогенеза. Более того, в этом случае нельзя исключить, что канцерогенез вообще развивается на эпигенетической основе, а генотоксичность канцерогенов является лишь их побочным свойством. Этому предположению, казалось бы, противоречат тысячи публикаций с сообщениями о полиморфизме в опухолях сотен генов, в том числе онкогенов и генов-супрессоров опухолей, мутации в которых могут вносить существенный вклад в их развитие. Однако такой полиморфизм, обнаруживаемый обычно в зрелых опухолях, нарастает по мере их прогрессии, которая идет спонтанно или под влиянием немутагенных промоторов, как правило, уже в отсутствие канцерогена, и поэтому ничего не говорит о механизме инициирующего действия последнего. Вопрос о роли мутаций на разных стадиях канцерогенеза — большой и сложный и заслуживает специального рассмотрения. Этому вопросу мы планируем посвятить отдельную работу.
Определяя рак как генетическую болезнь, Г.П.Георгиев [27] пишет, что он может быть связан «с потерей, или повреждением, или активацией, или, наконец, с привнесением извне определенных генов». Собственно генотоксическими при этом являются потеря и повреждение и только частично активация — в той части, в какой она является результатом повреждения или реаранжировки этих генов. Другой путь усиления активности онкогена, связанный с «усилением синтеза матричных РНК и в итоге синтеза белкового продукта онкогена и его накопления в клетке», может реализоваться на уровне регуляции этого синтеза, т.е. на эпигенетическом уровне, как это происходит в нормальном онтогенезе и при репаративных процессах. В настоящее время имеются идеи относительно того, как могут действовать канцерогены на уровне не структуры, а функции генома [28-31].
Работа выполнена при поддержке Российского фонда фундаментальных исследований (гранты №№ 97-04-49434 и 00-04-49548).
Литература
- Shivapurkar N., Virmani A.K., Wistuba I.I. et al. Deletion of chromosome 4 at multiple sites are frequent in malignant meso-thelioma and small cell lung carcinoma // Clin. Cancer Res. 1999. V. 5. P. 17-23.
- Тимофеева О.А., Филипенко М.Л., Каледин В.И. Мутации в 61 кодоне гена H-RAS в опухолях печени, индуцированных у мышей сильными и слабыми канцерогенами // Бюл. эксперим. биол. мед. 2000. Т. 129, № 1. С. 82-85.
- Sidransky D. Nucleic acid-base methods for the detection of cancer // Science. 1997. V. 278. P. 1054-1058.
- Ames B.N., Durston W.E., Yamasaki E., Lee F.D. Carcinogens are mutagens: a simple test system combining liver homogenates for activation and bacteria for detection // Proc. Natl Acad. Sci. USA. 1973. V. 70. P. 2281-2285.
- Васильев Ю.М. Социальное поведение нормальных клеток и асоциальное поведение опухолевых клеток. II. Клетки строят ткань // Соросовский образовательный журнал. 1997. № 5. С. 20-25.
- Анисимов В.Н., Лихачев А.Я., Напалков Н.П. Возникновение злокачественных опухолей у животных вследствие включения синтетического пиримидинового основания 5-бромо-2′-дезоксиуридина в ДНК // Вопросы онкологии. 1998. Т. 44, № 1. С. 19-22.
- Wiseman R.W., Miller E.C., Miller J.A., Liem A. Structure-activity studies of the hepatocarcinogenicities of alkenylbenzene derivatives related to estragole and safrole on administration to preweanling male C57BL/6J x C3H/HeJ F1 mice // Cancer Res. 1987. V. 47. P. 2275-2283.
- Rodrigues L.V., Dunsford H.A., Steinberg K.K. et al. Carcinogenicity of benzo[a]pyrene and manufactured gas plant resi-dues in infant mice // Carcinogenesis. 1997. V. 18. P. 127-135.
- Simmon V.F. In vitro mutagenicity assays of chemical carcinogens and related compounds with Salmonella typhimurium // J. Nat. Cancer Inst. 1979. V. 62. P. 893-899.
- Гуляева Л.Ф., Вавилин В.А., Ляхович В.В. Ферменты биотрансформации ксенобиотиков в химическом канцерогенезе. Аналитический обзор. Новосибирск: Изд-во ГПНТБ, 1999. 86 с.
- Quillardet P., Hofnung M. The SOS chromotest, a colorimetric bacterial assay for genotoxins: procedures // Mutat. Res. 1985. V. 147. P. 65-78.
- Hude W., Behm C., Gurtler R. Basler A. Evaluation of the SOS chromotest // Mutat. Res. 1988. V. 203. P. 81-94.
- Maron D.M., Ames B.N. Revised methods for the Salmonella mutagenicity test // Mutat. Res. 1983. V. 113. P. 173-215.
- Каледин В.И., Серова И.А., Семенова Л.А. Неодинаковая предрасположенность к развитию спонтанных и индуцированных опухолей печени у мышей разных линий и их гибридов // Эксперим. онкология. 1990. Т. 12, № 4. С. 28-30.
- Тимофеева О.А., Филипенко М.Л., Каледин В.И. Изучение корреляции между генотипом гена K-RAS и чувствительностью мышей к химической индукции опухолей легкого // Генетика. 1999. Т. 35. С. 1309-1312.
- Travis C.C., Richter Pack S.A., Salsbury A.W., Yambert M.W. Prediction of carcinogenic potency from toxicological data // Mutat. Res. 1990. V. 241. P. 21-36.
- Серова И.А., Каледин В.И., Семенова Л.А. Наследование чувствительности к индукции опухолей печени и стимуляции синтеза
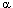 -фетопро-теина на ранних этапах гепатоканцерогенеза, индуцированного о-аминоазотолуолом у мышей DD/He и CC57BR/Mv // Эксперим. онкология. 1992. Т. 14, № 1. С. 31-35.
-фетопро-теина на ранних этапах гепатоканцерогенеза, индуцированного о-аминоазотолуолом у мышей DD/He и CC57BR/Mv // Эксперим. онкология. 1992. Т. 14, № 1. С. 31-35. - Roe F.J.C. Neonatal induction of hepatic and other tumors // Mouse hepatic neoplasia. Amsterdam а.о., 1975. P. 133-142.
- Kemp C.J., Drinkwater N.R. Genetic variation in liver tumor susceptibility, plasma testosterone levels, and androgen receptor binding in six inbred strains of mice // Cancer Res. 1989. V. 49. P. 5044-5047.
- Parodi S., Zunino A., Ottagio L. et al. Lack of correlation between the capacity of inducing sister-chromatid exchanges in vivo and carcinogenic potency, for 16 aromatic amines and azo derivatives // Mutat. Res. 1983. V. 108. P. 225-238.
- Hagmar L., Bonassi S., Stromberg U. et al. Chromosomal aberrations in lymphocytes predict human cancer: a re-port from the European study group on cytogenetic biomarkers and health // Cancer Res. 1998. V. 58. P. 4117-4121.
- Liddle C., Legraverend C., Blanck A. et al. Sexual dimorphism of hepatic steroid metabolism and its significance for chemical carcinogenesis // Hormonal carcinogenesis. В.: Springer Verlag, 1992. P. 124-129.
- Каледин В.И., Роничевская Г.М., Зверева Л.Н. Несоответствие между канцерогенным и мутагенным эффектами аминоазокрасителей у подсосных мышей // Докл. РАН. 1994. Т. 335. С. 810-812.
- Hubner P., Groux P.M., Weibel B. et al. Genotoxicity of ethyl carbamate (urethane) in Salmonella, yeast and human lymphoblastoid cells // Mutat. Res. 1997. V. 390. P. 11-19.
- Платонова Г.М., Погосянц Е.Е. Влияние тимина на возникновение аденом в легких мышей при действии уретана и N-гидроксиуретана // Вопросы онкологии. 1969. Т. 15, № 2. С. 66-71.
- Турусов В.С., Ракитский В.Н. Пестициды как негенотоксические канцерогены // Вопросы онкологии. 1999. Т. 45, № 2. С. 118-123.
- Георгиев Г.П. Как нормальная клетка превращается в раковую // Соросовский образовательный журнал. 1999. № 4. С. 17-22.
- Felsher D.W., Bishop J.M. Transient excess of MYC activity can elicit genomic instability and tumorigenesis // Proc. Natl Acad. Sci. USA. 1999. V. 96. P. 3940-3944.
- Macleod M.C. A possible role in chemical carcinogenesis for epigenetic, heritable changes in gene expression // Molecular carcinogenesis. 1996. V. 15. P. 241-250.
- Каледин В.И., Гуляева Л.Ф., Ильницкая С.И. и др. За нарушение глюкокортикоидной индукции тирозинаминотрансферазы в печени ответственны активированные метаболиты гепатоканцерогенов // Докл. РАН. 1997. Т. 357. С. 126-129.
- Меркулова Т.И., Каледин В.И., Кропачев К.Ю. и др. Влияние орто-аминоазотолуола на глюкокортикоидную индукцию тирозинаминотрансферазы у чувствительных к его гепатоканцерогенному действию мышей реализуется через фактор транскрипции HNF3* // Докл. РАН. 1998. Т. 361. С. 700-703.
Некоторые термины
Бактериальные тесты на мутагенность — тесты, позволяющие выявлять мутагенность химических соединений или продуктов их биотрансформации по индукции мутаций у бактерий специально сконструированных штаммов. В тесте Эймса это ауксотрофные по гистидину штаммы S. Typhimurium с повышенной проницаемостью клеточной стенки и дефектные по системам репарации ДНК. Мутации выявляются по числу прототрофных колоний (выросших на среде без гистидина). В SOS-хромотесте используются штаммы E. Сoli, у которых нарушение репликации ДНК, вызванное ее повреждением, ведет к индукции так называемого SOS-ответа, характеризующегося усилением экспрессии ряда генов, участвующих в ее репарации. Генотоксичность испытуемых соединений в этом тесте определяют по степени индукции
![]() -галактозидазы, структурный ген которой находится под контролем промотора одного из генов SOS-ответа; в качестве контроля служит щелочная фосфатаза, не индуцирующаяся в условиях опыта. Активность ферментов определяется колориметрически, откуда и название хромотест. В обоих тестах для активации соединений принято использовать микросомальные и цитозольные ферменты печени крыс, предобработанных индукторами этих ферментов.
-галактозидазы, структурный ген которой находится под контролем промотора одного из генов SOS-ответа; в качестве контроля служит щелочная фосфатаза, не индуцирующаяся в условиях опыта. Активность ферментов определяется колориметрически, откуда и название хромотест. В обоих тестах для активации соединений принято использовать микросомальные и цитозольные ферменты печени крыс, предобработанных индукторами этих ферментов.
Генотоксический канцерогенез — канцерогенез, развивающийся на основе структурных изменений генома;
генотоксические канцерогены — канцерогены, повреждающие ДНК (вызывающие генные или хромосомные мутации).
Концепция двустадийного канцерогенеза — представление о канцерогенезе как о двустадийном процессе с наследственным изменением клетки на первой стадии (стадии инициации) и со стимуляцией ее размножения на второй (стадии промоции). Считается, что при инициации происходит мутационное повреждение ДНК, хотя известны немутагенные канцерогены, являющиеся активными инициаторами опухолевого процесса (например, уретан).
Малигнизация — озлокачествление.
Мезотелиома — злокачественная опухоль легких человека, затрагивающая плевру и брюшину; вызывается волокнами асбеста.
Филадельфийская хромосома — специфическая хромосома, образующаяся при транслокации между длинными плечами 9 и 22 хромосом человека; характерна для некоторых форм хронического миелоидного лейкоза. Впервые была описана в Филадельфии.
В.И.Каледин, Е.А.Васюнина, Л.П.Овчинникова, Г.М.Роничевская, Л.Н.Зверева, С.И.Ильницкая, Институт цитологии и генетики СО РАН, Новосибирск

